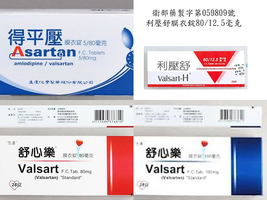
美國食品和藥物管理局(FDA)周五(9月28日)表示,將不再允許進口含有由浙江華海藥業產品成份的藥品,以及不允許進口該公司的藥物成份。此前,華海公司製造的原料藥中被發現一種可能的致癌物質。
華海藥業是高血壓藥物纈沙坦(valsartan)的製造商,因纈沙坦內含有可能的致癌物,今年7月,包括美國在內的全球多個國家展開藥物召回行動。纈沙坦除了治療高血壓外,還可以治療心力衰竭。
歐洲當局周五也表示,他們發現華海沒有遵守良好的生產規範,不再授權該公司在中國臨海工廠生產纈沙坦。
歐洲藥品管理局表示,正在考慮對該地點生產的其它產品採取進一步行動。
華海工廠發現重大製造工藝問題
今年7月,歐洲藥品管理局和美國食品及藥物管理局發佈警報,指稱浙江華海提供的降血壓藥物中含有致癌成份,導致全球22個國家發起召回受影響藥物的行動。
路透社報道,美國食品和藥物管理局表示,在檢查華海工廠期間發現重大製造工藝問題後,正在停止進口該公司的藥物。FDA表示,在中國製造商確定如何引入雜質,並改進其質量控制系統之前,凍結進口的指令將保持不變。
華海公司的英文網站表明,該公司生產50多種藥物、活性藥物成份和用於各種藥物的中間產品,用於治療高血壓、抑鬱症和其它疾病。目前還不清楚有多少種藥物或原料藥出口到美國。
美國食品和藥物管理局發言人卡恩(Jeremy Kahn)表示,該機構並不擔心此時因進口禁令導致的額外藥物短缺問題。
在9月20日發佈在FDA網站上的華海檢驗報告中,FDA指出了一系列嚴重問題,包括華海公司的質量管理體系,評估變更對其製造過程影響的方法,以及處理含有雜質產品的方式等。
總體來說,在今年7月底到8月初,兩名調查員被派往華海工廠進行大約兩周的檢查。8月3日,基於調查出具了三份報告,列出了11個問題。
監管機構和行業顧問表示,當華海於2012年改變其製造纈沙坦的流程時,是最有可能引入NDMA的時機。美國食品及藥物管理局局長卡恩在8月一封電子郵件中告訴路透社,纈沙坦製造流程的變更被認為導致了NDMA的引入。
「對中國製造的藥品缺乏信任」
英國藥品監管機構表示,中國製造商生產的活性藥物成份產量佔全球的40%。
數據顯示,中國擁有超過5,000家API(原料藥生產商),其中約500家是出口商。去年出口額達290億美元。
這些生產商為Teva Pharmaceutical等仿製藥製造商,以及強生和諾華等跨國公司供應原料。根據行業估計,美國大約80%的API來自中國和印度。
《金融時報》8月6日報道,因中國藥物質量問題頻發,美國食品及藥物管理局(FDA)向中國醫藥製造商發出的警告信函數量已經從2014年的5個,上升到去年的22個。這是中國藥物被美國列入進口黑名單的前兆。
「許多(中國)API公司並沒有嚴格遵循既定的(製造)流程,也沒有嚴格記錄數據。」安永在中國合夥公司的林約翰(John Lin)說。
醫療保健智囊團黑斯廷斯中心(Hastings Center)的顧問吉布森(Rosemary Gibson)表示,「現在對中國製造的藥品缺乏信任。」
她說:「公眾希望他們的藥物安全。這種隱藏在纈沙坦(華海公司生產的藥物)中的致癌物引發了一個問題,即中國生產的其它產品是否與我們接受的全球標準相悖。」
--------------------
向每位救援者致敬
願香港人彼此扶持走過黑暗
--------------------
🔔下載大紀元App 接收即時新聞通知:
🍎iOS:https://bit.ly/epochhkios
🤖Android:https://bit.ly/epochhkand
📰周末版實體報銷售點👇🏻
http://epochtimeshk.org/stores